ISO管理体系认证咨询
- SA8000社会责任体系认证
- iso50001能源管理体系认证_能源
- GB/T50430建筑行业认证
- 十环认证|十环标志认证
- TS16949|IATF16949汽车
- ISO22000食品安全管理体系认证
- ISO45001职业健康与安全管理体系
- ISO14001环境管理体系认证
- ISO9001质量管理体系认证
- ISO22301业务连续性管理体系认证
- 三体系认证
- GBT29490-2013知识产权管理
- ISO13485医疗器械质量管理体系认
- 欧盟CE证书|CE证书查询
- ISO37001反贿赂管理体系认证
- REACH|ROHS认证|检测报告
- ISO55001资产管理体系认证
- CCC|3C认证|CCC认证查询
- 危害分析与关键控制点(HACCP)体系
- AAA级企业信用等级证书|信用认证证书
- 美国石油协会API认证
- haccp食品管理体系认证
- ISO37301:2021 合规管理体
- ISO22716|化妆品认证__化妆品
- ISO10012测量管理体系认证
- GB/T 39001-2019(ISO
- iso28000 供应链安全管理体系认
- 美国FDA(FCE/SID)注册_医疗
- ISO14064碳排放认证_企业温室气
- ISO14067产品碳足迹认证
- ISO41001设备设施管理体系认证
联系方式
-
北京:海淀区西三环昌运宫紫竹桥
136-8120-0268
上海:闵行区光华路18号
152-2175-9315
青岛:市南区中山路10号
137-9194-1216
杭州:滨江区伟业路1号
158-6716-8335
西安:西安市未央区未央路80号
139-0928-9277
深圳:南山区粤海街道环东路西环北路北滨海之窗花园
130-7782-9315
全国免费咨询:4006-010-725
业务QQ:2970890153
你现在位置:网站首页 >ISO管理体系认证咨询 >美国FDA(FCE/SID)注册_医疗器械_化妆品_酸化/低酸罐藏(罐头)食品美国FDA(FCE/SID)注册_医疗器械_化妆品_酸化/低酸罐藏(罐头)食品
FDA扩大EUA(紧急使用授权)范围,更多口罩可作为医疗口罩进入美国
文章来源:FDAImports 编辑:北京华道众合咨询公司
3月24日,美国FDA发布了关于扩大紧急使用授权(Emergency Use Authorization ,简称EUA)范围的指导文件,将EUA扩展至“进口的、非NIOSH批准的一次性过滤口罩(FFR),这些口罩应当是经过验证、符合特定性能的标准,或在某些国家已经获得了营销许可”。
高级律师Ben England 对此解释道,“这样一来,那些通常情况下不能用于医疗用途的非医用工业口罩现在则有可能可以作为医用口罩,并进口到美国市场。” 目前FDA似乎没有要求这类器械进行FDA注册和产品列名,不过这一点之后可能会发生变化。然而,FDA希望制造商能够做到:在自己网站上发布产品的英文信息(如使用方法、适应症等);保证标签标识符合CDC的要求;给医院和诊所写信并附上使用说明和免责声明等。
关于FDA发布的这封EUA通知,请看链接:https://www.fda.gov/media/136403/download
下面我们总结归纳了这封EUA通知的主要内容,并简要解释了口罩生产商和进口商接下来需要如何做才能符合EUA授权的要求。无论如何,这对每个人来说都是一个好消息,不过企业接下来仍需要完成一些重要和详细的步骤和工作。
符合本次EUA授权的口罩(respirator)
1. 经过设计、评估和验证后,符合既定的性能标准,并具有相应可接受产品类别的一次性过滤口罩(FFRs)如下:
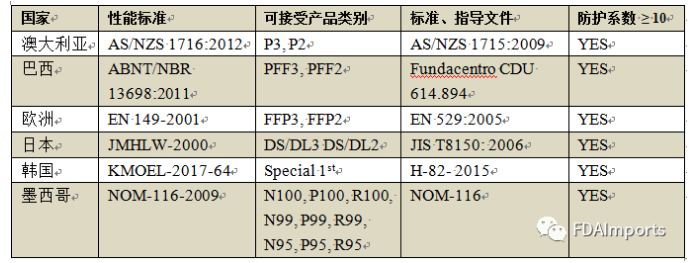
2. 具备下列其中一个监管机构营销授权的一次性过滤口罩:
欧盟CE认证
澳大利亚ARTG(Australian Register of Therapeutic Goods)准入证书
加拿大卫生部许可(Health Canada License)
日本的PMDA(Pharmaceuticals and Medical Device)或 MHLW(Ministry of Health Labour and Welfare)许可
企业应当如何做?
口罩生产商或者进口商必须向美国FDA以电子邮件形式提出申请,表明他们计划进口非NIOSH批准的一次性口罩符合上述1和/或2的条件。为使FDA判断生产商或进口商所申请的一次性口罩是否列入EUA授权的口罩列表,生产商或进口商申请授权的电子邮件应该当包含以下信息:
详细列出生产商、产品型号、其他监管机构或者认证机构出具的营销授权或证书,合格证书(如果有的话)、产品所适用的性能标准,以及其他适用的指导文件;
大致估算一下在这次紧急公众卫生事件期间所要进口的口罩数量;
产品标签的副本。口罩必须至少符合本次EUA条件中condition A和condition B(见下文)的标签标识要求;
一旦收到上述信息和其他符合上述类别的附加信息,FDA便会对这些进口一次性口罩的适用性进行确认,然后再会回复生产商和进口商的电子邮件,通知生产商的口罩获得EUA授权,被列入Exhibit 1。
EUA授权条件(Conditions):
获得EUA授权的口罩生产商或进口商仍需要进行一些附加步骤。生产商需要完成以下步骤,并告知FDA。
获得EUA授权的口罩生产商:
Condition A - 获EUA授权的口罩生产商需要在其网站上以英文形式公布所有授权口罩型号的预期使用用途和其他说明(如拟合度测试等)。除此之外,生产商必须将网站地址以邮件形式告知FDA,表示已经符合这项要求。FDA将会通过EUA网站(https://www.fda.gov/medical-devices/emergency-situations-medical-devices/emergency-use-authorizations#covid19ppe.)向公众公开这项信息。如果网站地址如有任何变动,生产商必须及时通知FDA。
Condition B - 生产商必须准备一封英文信函,该信函需要发给每个接收授权口罩的终端客户(如医院等)。该信函内容必须包括授权口罩的生产商、型号、预期用途、生产商网站(如有)等。
Condition C - 获得授权的口罩生产商应将EUA的条款和条件通知给进口商(如有),并确保接收授权口罩的终端客户(如每家医院等)也收到Condition B所要求的信息。
Condition D - 获得授权的口罩生产商将有一个合适的流程来报告他们知道的不良事件,并将这些报告发送给FDA(该项是一个要求。制造商必须服从)。
Condition E - 针对在美国所使用的授权口罩,其所有描述性印刷材料应符合美国CDC在COVID-19爆发期间的相关提议,以及此次EUA中的相关规定。(该项不需要直接向FDA报告,只要制造商(或进口商)确保能完成即可。这只是Condition B的延伸。)
Condition F - 针对在美国所使用的授权口罩,其所有说明性印刷材料都不能明确表明或暗示该产品对预防COVID-19是安全或有效的。(该项不需要直接向FDA报告,只要制造商(或进口商)确保能完成即可。这只是Condition A、B、E的延伸。)
Condition G - 授权口罩的生产商应当保存所有跟EUA相关的记录,直到FDA另行通知。根据要求,这些记录将会用于FDA审查。(再次声明,该项不需要直接向FDA报告,他们只需要保留所有Condition A至F的合规记录,以及出口到美国的记录文件。)
获得授权的口罩进口商:
Condition H - 针对在美国所使用的授权口罩,其所有描述性印刷材料应与美国CDC在COVID-19爆发期间的建议一致,并与本EUA中规定的条件一致。(重复Condition E)
Condition I - 任何与授权口罩使用相关的描述材料都不能明确表明或暗示该产品对预防COVID-19是安全或有效的。(重复Condition F)
Condition J - 授权口罩的进口商将通知生产商关于本次EUA的条款和条件,并确保终端客户(如医院等)在接收授权口罩产品的同时,也能收到Condition B 所需的信息。(本条与Condition C是互惠的,如果进口商能够协助生产商的话,则实施起来并不困难。)
Condition K - 在本次紧急公共卫生事件结束前,授权口罩的进口商需保留所有跟本次EUA相关的记录。(进口商版的Condition G)
【返回 】
